코로나19 백신·치료제 허가심사 기간 180일→40일
 북기기
0
194
0
0
2020.12.27 11:54
북기기
0
194
0
0
2020.12.27 11:54
식품의약품안전처는 27일 최근 국내외에서 개발 중인 신종 코로나바이러스 감염증(코로나19) 백신 및 치료제의 허가과정을 설명했다.
해외 제약사 아스트라제네카, 얀센(존슨앤드존슨), 화이자의 백신에 대해서는 현재 식약처 사전검토가 진행 중이다.
국내 항체치료제 개발 업체 셀트리온은 이달 중에 사용승인을 신청할 예정이라고 밝힌 바 있다.
의약품 허가 절차는 제조·수입업체가 품목허가를 신청하면 시작된다. 업체는 허가 신청 시 약사법 제31조·제42조에 규정된 허가에 필요한 비임상, 임상, 품질 등의 자료를 식약처 '의약품안전나라'에 제출해야 한다.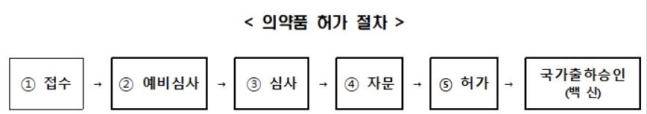 의약품 허가 절차
의약품 허가 절차
[식품의약품안전처 제공. 재판매 및 DB 금지]
식약처는 품목별 사전검토 및 허가전담심사팀의 신속한 심사를 통해 180일인 기존 처리 기간을 단축해 40일 이내에 처리하는 것을 목표로 하고 있다.
생물학적 제제인 백신은 국가가 한 번 더 품질을 확인하는 국가출하승인을 거쳐야 유통, 판매를 할 수 있다.
코로나19 백신의 경우 통상 2∼3개월 이상인 기존 국가출하승인 처리기간을 단축해 20일 이내에 처리하는 것을 목표로 추진할 계획이다.
의약품은 품목허가를 받아야 제조 또는 수입할 수 있으나, 약사법 제85조의2에서는 특례 승인 절차를 규정하고 있다.
질병관리청 등 관계부처의 장은 감염병 등에 대처하기 위해 식약처장에게 특례 제조나 수입을 요청할 수 있다. 이를 승인받으면 국내에 품목허가를 받지 않은 의약품을 제조하거나 수입할 수 있다.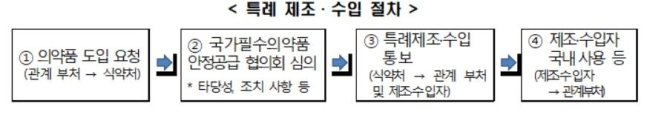 특례 제조 및 수입 절차
특례 제조 및 수입 절차
[식품의약품안전처 제공. 재판매 및 DB 금지]
백신은 전 세계 다수 업체에서 임상 3상 시험을 하고 있다.
이달 25일 기준 현재 화이자 백신은 미국, 영국 등 8개국에서 긴급사용승인을 받았고, 유럽연합과 스위스에서 조건부 허가를 받았다. 모더나 백신은 미국에서 긴급사용승인을 받았다.
국내에서는 현재 5개 제품이 임상 중이며, 대부분 초기 단계인 1상이나 1/2상 단계에 있다.
치료제의 경우 다국적 제약사 릴리, 리제네론에서 항체치료제 임상 3상이 진행 중이며, 미국에서 긴급사용승인을 받았다.
관절염 치료제 성분인 '바리시티닙' 등 기존 의약품에 대해 코로나19 치료 효능을 추가하기 위한 임상도 이뤄지고 있다.
국내에서는 새로운 코로나19 치료제로 개발 중인 항체치료제 등 총 15개 제품(13개 성분)이 임상 중이다.
[표1] 코로나19 백신 임상 시험 진행 현황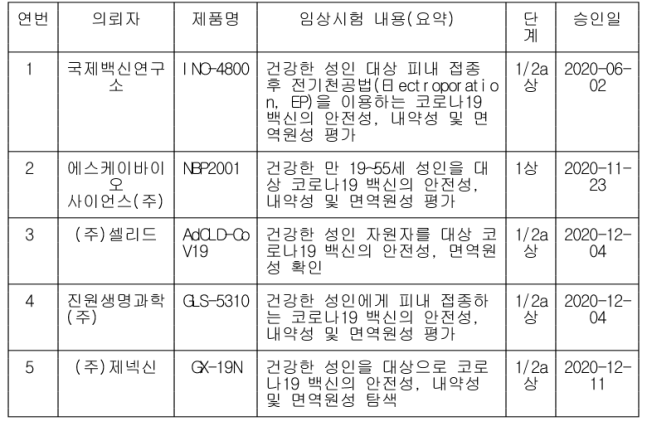
[표2] 코로나19 치료제 임상 시험 진행 현황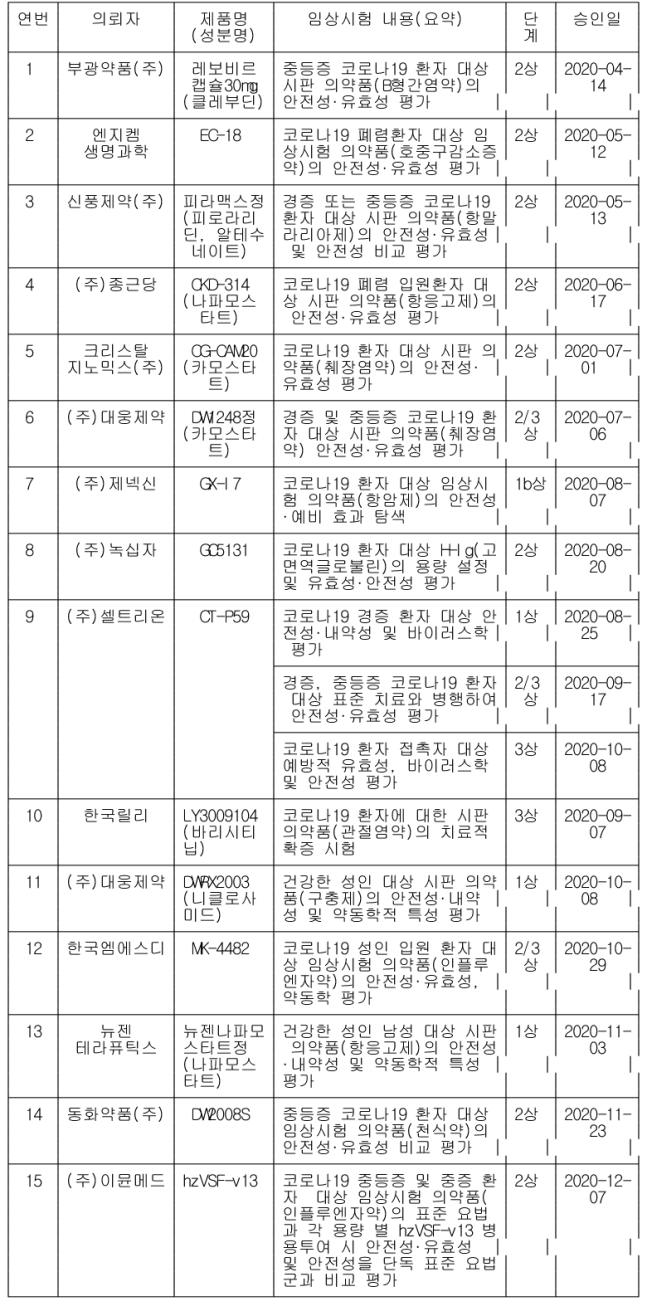
ㅡㅡ지우지 말아 주세요 ㅡㅡ
온라인카지노 커뮤니티 일등!! 온카 https://casinoleak.com




 보헤미안
보헤미안 streem
streem 비트팟
비트팟 비공개
비공개 모스코스
모스코스 마법사
마법사 비노
비노 이실장
이실장 오잉
오잉 아이리스
아이리스 겨울엔오사카로
겨울엔오사카로 스트롱맨
스트롱맨